Осмос та осмотичний тиск, вчитель біології ольга Коновалова
По-першу чергу потрібно зрозуміти, що в природі практично в будь-якої рідини розчинені ті чи інші речовини. Будь то вода з калюжі, озеро Байкал, цитоплазма клітини або плазма крові. Речовини можуть бути розчинені найрізноманітніші, в тому числі і солі. Явища осмосу виникають тоді, коли два розчини з різною концентрацією солей розділені напівпроникною мембраною, через яку може проходить розчинник (наприклад, вода), але не можуть пройти молекули розчинених речовин.
Тут важливо відволіктися від безпосередньо явища осмосу і розібратися в такому терміні як осмотичний тиск. Наукове визначення можна прочитати на вікі. Але нам важливо розібратися з явищем на простішому для розуміння рівні. У підручнику з фізики виявився дуже хороший приклад: якщо кинути в склянку з водою зморщену родзинку, то вона через деякий час розбухне. Всередину її увійде вода (її молекули малі і добре проходять через шкірку родзинки), а цукру і інші речовини залишаться всередині ягоди (їх молекули занадто великі). Вода буде прагне вирівняти концентрацію солей всередині і зовні, але в якийсь момент настане межа місткості і процес надходження води всередину зупиниться. Осмотичний тиск - це тиск, який слід прикласти до розчину щоб припинити надходження води всередину.
Повернемося до осмосу.
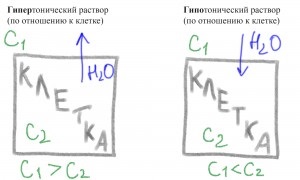
Якщо концентрація солей зовні клітини вище, ніж усередині, то вода буде прагнути з клітки в навколишній її розчин розбавити концентрацію. Клітка буде втрачати воду. Такий розчин називається гіпер тонічний.
Якщо концентрація солей зовні менше, ніж усередині клітини, то вода буде прагне всередину для того що б зрівняти концентрацію солей. Клітка буде наповнюватися водою і може лопнути, якщо не буде робити активних дій для видалення води. Такий розчин називається гіпо тонічний.
Якщо ж концентрація солей і зовні і всередині дорівнює, то буде відбуватися взаємний обопільний обмін без трагічних наслідків. Такий розчин називається з тонічний.
Виходить, що осмос - це процес однобічної дифузії (проникнення, надходження) через напівпроникну мембрану молекул розчинника в бік більшої концентрації розчиненого речовини з обсягу з меншою концентрацією розчиненої речовини.
Розуміння закономірностей осмотических явищ важливо в таких темах, як надходження і переміщення розчинів в рослині, особливо видільних систем прісноводних і морських жителів (і одноклітинних і багатоклітинних), використання фізіологічного (а по суті ізотонічного) розчину для внутрішньовенних ін'єкцій.
Для розуміння важливості осмотических явищ наведемо приклад: концентрація солей в складі розчину для внутрішньом'язової ін'єкції має дорівнювати концентрації солей в плазмі крові (тому розчин називають фізіологічним, тобто відповідним для фізіології людини). З точки зору осмотических явищ такий розчин називають ізотонічним. В цілому після ін'єкції концентрація солей в плазмі крові не змінюється і життєдіяльність клітин тече своєю чергою.
Але якщо сталася помилка і розчин ін'єкції більш концентрований, то з найближчих клітин крові (після уколу і введення розчину) в плазму почне надходити вода ( «прагнучи» розбавити більш концентровану плазму) і клітини крові, наприклад, еритроцити будуть втрачати воду і с'ежіваться. А відповідно втрачати функціональність.
Якщо ж розчин для ін'єкції менш концентрований, ніж плазма крові. Те вода з плазми почне надходити в клітини крові, наприклад, еритроцити і вони стануть набухати і лопатися. Що теж сильно вплине на функціональність тканини.